V poslední době dochází k nárůstu případů padělání léčivých přípravků,[1] které představuje vážné ohrožení zdraví. Reakci na tuto problematiku představuje tzv. protipadělková směrnice (z angl. Falsified Medicines Directive, dále také jako „Směrnice“),[2] přijatá na půdě EU. Již na úvod je potřeba zmínit, že Směrnice nedopadá na prodej všech léčivých přípravků.
Směrnice přináší řadu pravidel a povinností pro výrobu, distribuci a výdej léčivých přípravků (dále také jako „přípravek“), přičemž přináší čtyři základní okruhy úpravy, mezi které řadíme otázku ochranných prvků, správné lékárenské praxe, společného loga při internetovém prodeji přípravků a sledovatelnosti API.[3] K provedení oblasti ochranných prvků, zejména pak jejich definování, ověřování a systému uložišť slouží prováděcí nařízení o stanovení podrobných pravidel pro ochranné prvky uvedené na obalu humánních léčivých přípravků (dále také jako „Nařízení“),[4] které nabude účinnosti 9. února 2019.[5] K tomuto datu tak musí všechny nově vyrobené přípravky splňovat podmínky stanovené Nařízením. Přípravky, které byly vyrobeny před tímto datem lze dále distribuovat a vydávat, ty nově vyrobené však musí splňovat níže uvedená kritéria.
Ochranné prvky
Problém padělaných léčivých přípravků zahrnuje zejména otázku falešných obalů, nesprávného složení či nízké hladiny obsažených účinných látek. K nejčastěji padělaným přípravkům patří zejména hormony, přípravky na erektilní dysfunkci či protinádorové přípravky, které z hlediska ceny spadají do skupiny velmi drahých přípravků.
Nová pravidla užívání ochranných prvků nedopadají na všechny přípravky, nýbrž pouze na tři konkrétní skupiny přípravků vymezených v čl. 2 Nařízení. První skupinu tvoří přípravky podléhající omezení výdeje na lékařský předpis, na které nedopadá výjimka dle přílohy č. 1 Nařízení (mezi přípravky, které se nesmí ochrannými prvky označovat patří například homeopatika, radiofarmaka či medicinální plyny). Druhou skupinu tvoří přípravky nepodléhající omezení výdeje na lékařský předpis uvedené v příloze č. 2 Nařízení (tuto skupinu tvoří pouze Omeprazol ve formě enterosolventní tvrdé tobolky o síle 20 mg či 40 mg). Poslední skupinu, která je dotčena úpravou, tvoří přípravky, na které členské státy EU rozšířily oblast působnosti.
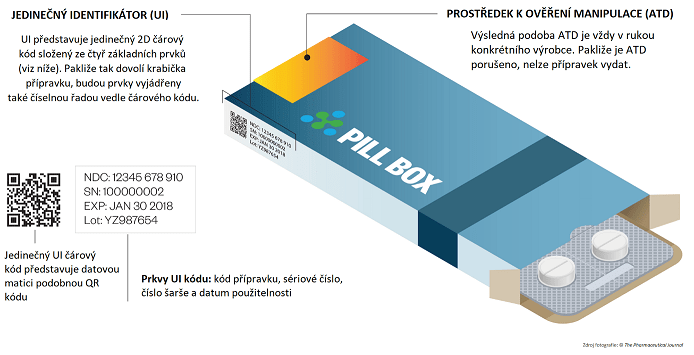
První z ochranných prvků představuje jedinečný identifikátor (z angl. Unique Identifier, dále také jako „UI“). Jedinečný identifikátor představuje „ochranný prvek umožňující ověřit pravost a identifikaci jednotlivého balení léčivého přípravku.“[6] Další funkcí UI je ověření data použitelnosti a sledování cesty přípravku v rámci distribuce. Součástí UI je série numerických a alfanumerických znaků skládající se z kódu přípravku, který umožňuje identifikovat název, formu, sílu, velikost a typ jeho balení, sériového čísla, úhradového čísla, čísla šarže a data použitelnosti. Každé balení s léčivým přípravkem musí ode dne účinnosti Nařízení obsahovat dvojrozměrný čárový kód ve formátu čitelném okem, nejčastěji pak formou obdobnou QR kódu. Tento kód musí být ve většině případů na balení jediným. Ponechání EAN kódu spolu s UI kódem lze pouze v případě, kdy uvedení obou neohrozí čitelnost a zaměnitelnost s UI kódem. Umístění samotného UI kódu není Nařízením stanoveno. Léčivé přípravky, na které úprava nedopadá, mohou stále obsahovat klasický EAN kód, jak tomu bylo doposud.
Druhý ochranný prvek zavedený novou úpravou představuje tzv. prostředek k ověření manipulace (z angl. Anti-Tamper Device, dále také jako „ATD“). Účelem ATD je ověřit, zdali bylo s obalem léčivého přípravku manipulováno (např. zdali došlo k otevření balení). Z praktického hlediska si lze představit např. fóliovou přelepku víčka či přelepku papírové krabičky přípravku.
Ověřování ochranných prvků
Podstatou celé úpravy je povinné ověřování výše uvedených ochranných prvků při výrobě, distribuci a výdeji. Při ověřování dochází ke kontrole pravosti a statusu UI, neporušenosti ATD, data použitelnosti a dalších informací o přípravku (např. informace o jeho stažení, zcizení či určení k likvidaci). V případě výpadku systému je osoba provádějící ověření či vyřazení UI povinna si jej zaznamenat a následně, až to bude možné, přípravek ověřit a vyřadit.
Výrobce přípravku je povinen označit vnější, případně vnitřní obal dvojrozměrným čárovým kódem, vést záznamy o veškerých úkonech provedených s UI, a to alespoň po dobu jednoho roku od uplynutí data použitelnosti daného balení, a v neposlední řadě zajistit to, aby byl UI nahrán do centrálního uložiště.
Distributor je povinen ověřovat jednak přípravky obdržené ze strany výrobce, jednak přípravky, které mu byly vráceny ze strany oprávněných osob či také přípravky, které obdrží od distributora jiného. To neplatí, jedná-li se o distribuci mezi dvěma sklady téhož subjektu. Distributorům je dána možnost ověřit dodané přípravky výrobcem pomocí tzv. souhrnného UI. V případě, kdy distributor pojme podezření o pravosti UI či o možné manipulaci s ATD, nesmí tento přípravek dále dodat či vyvézt k dalšímu užití. Distributor je naopak povinen tuto skutečnost nahlásit příslušnému orgánu.
K nejdůležitějšímu ověřování dochází oprávněnými osobami. Tyto osoby musí jednak ověřit ochranné prvky, jednak vyřadit UI ze systému v okamžiku, kdy přípravek veřejnosti vydávají. Tato povinnost může administrativně zatížit oprávněnou osobu při výdeji přípravku, neboť je potřebné naskenovat čtečkou každé balení zvlášť (oproti dosavadního naskenování jednoho balení a uvedení počtu balení v systému). Nařízení umožňuje privilegované ověření a vyřazení UI, které spočívá v možnosti jeho provedení kdykoliv, kdy je přípravek ve fyzickém držení zdravotnického zařízení, za předpokladu, že mezi dodáním přípravku do zdravotnického zařízení a jeho vydáním veřejnosti nedojde k jeho prodeji jinému subjektu. To tak umožňuje zdravotnickému zařízení provést kontrolu v předstihu před samotným výdejem. Z hlediska úpravy je potřebné vymezit pojem zdravotnické zařízení. Tímto institutem se rozumí nemocnice, zařízení pro hospitalizaci pacientů, ambulantní zařízení nebo poliklinika. Z hlediska každodenní praxe nemocnic či poliklinik je tak zásadní, že mohou ověřit a vyřadit UI přípravky v předstihu, čímž se vyhnou případným prodlevám při samotném použití přípravku. Privilegované ověřování a vyřazování UI však nedopadá na lékárny, ve kterých dochází k samotnému výdeji nejčastěji.
Systém
Aby mohla nově nastolená pravidla pro ověřování pravosti léčivých přípravků fungovat, zřizuje Nařízení systém uložišť. Systém uložišť se skládá z centrálního uložiště (European Medicines Verification System, EMVS) a vnitrostátních uložišť v jednotlivých zemích (případně pak nadnárodních uložišť zaštiťujících vícero vnitrostátních uložišť). Tyto uložiště spravují neziskové právní subjekty, a to Evropská organizace pro ověřování léčiv (EMVO) na centrální úrovni a Národní organizace pro ověřování pravosti léčiv (NOOL) v rámci České republiky.
Národní uložiště, které je propojeno s uložištěm centrálním, slouží jako verifikační platforma k ověřování pravosti přípravků. Mimo technické požadavky na software uložišť stanovuje Nařízení minimální úkony, které systém uložiště musí splňovat. Mezi tyto pak řadíme možnost ověření pravosti aktivního UI, spuštění výstrahy v případě, kdy se nepodaří ověřit pravost aktivního UI se současným vyznačením potencionálního případu padělání, možnost vyřazení UI ze systému či synchronizaci statusu jedinečného UI mezi vnitrostátním a centrálním uložištěm. Ověření data použitelnosti či uvedení informace o zcizení představují praktické nástroje zjednodušující bezproblémový výdej oprávněným subjektům, neboť systém výstrahou upozorní na problematické balení přípravku a k samotnému výdeji oprávněnou osobu nepustí.
Článek byl původně publikován v odborném a vzdělávacím časopise určeném pracovníkům v lékárnách Pharma News.
[1] Podle sdělení WHO ze dne 31.1.2018 tvoří padělané léčivé přípravky 10% objemu farmaceutického trhu.
[2] Směrnice Evropského parlamentu a Rady č. 2011/62/EU ze dne 8. června.
[3] Z anglického Active Pharmaceutical Ingredient.
[4] Nařízení Komise v přenesené působnosti (EU) č. 2016/161 ze dne 2. října 2015.
[5] Belgie, Itálie a Řecko nebudou tímto datem vázány, neboť využily možnost prolongace účinnosti.
[6] Článek 3 odst. 2 písm. a) Nařízení 2016/161.


Diskuze k článku ()